Skript - Energetik
Einführung
Mit Hilfe dieses Skriptes sollen Sie sich das Thema Energetik selbstständig erarbeiten. Selbstständig bedeutet wirklich SELBST und STÄNDIG.
Der Unterricht im klassischen Sinne hat aufgehört. Sie können Ihr eigenes Tempo bestimmen und sich Ihre eigenen Partner suchen. Sollte die Lehrkraft nicht da sein, haben Sie nun immer das Material um selbstständig zu arbeiten.
Die Lehrkraft soll Ihnen dabei als Berater zur Seite stehen. Wenn Sie Fragen haben oder auf Probleme stoßen, die Sie weder allein noch im Team lösen konnten, dann fragen Sie nach!
Für jedes Kapitel dieser Reihe ist angegeben, wie Sie vorgehen sollten. Die Vorüberlegungen sollen Ihnen helfen Wissen zu reaktivieren oder Wissenslücken zu schließen. Wenn Sie sich an die vorgegebenen Vorgehensweisen hallten, sollte es keine Probleme geben.
Vielleicht fragen Sie sich jetzt, warum die Lehrer so faul sein dürfen und Sie jetzt alles allein machen müssen. Der Grund ist recht einfach: die Lehrer haben alles bereits so vorbereitet, dass Sie sich intensiv mit einem Thema beschäftigen können. Dadurch bleibt es besser in Ihrem Gedächtnis. Sie lernen effektiver die Inhalte, verbessern Ihr eigenes Zeitmanagement und analysieren Ihre eigenen Fähig- und Fertigkeiten.
Symbole im Skript

In diesen Texten finden Sie Erklärungen und Hintergründe!
Die Quellen finden Sie in den Fußnoten. Diese Quellen können Ihnen auch als Quizvorbereitung helfen.
Übrigens, nicht alle Quellen sind Wikipedia. Aber es ist eine nützliche und in Chemie akzeptierte Quelle.
Bild: Information by dDara from the Noun Project

An diesen Stellen sollen Sie Ihr Wissen auffrischen!
Sie sollten die entsprechenden Themen schon vorher im (Chemie-)Unterricht behandelt
haben.
Falls nicht, arbeiten Sie Ihre Wissenslücken bitte selbstständig auf.
Bild: Arrow by Aleksandr Vector from the Noun Project

Es soll keine Langeweile aufkommen.
Wenn Sie mit den Aufträgen bereits fertig sind, während Ihre Gruppe noch arbeitet,
können Sie sich hier noch weiter in das Thema vertiefen.
Bild: thunder by Pascal Heß from the Noun Project

Dieses Symbol weißt immer auf eine Durchführung für ein Experiment hin.
Bild: Chemistry by Eucalyp from the Noun Project

Das Zeitsymbol soll Ihnen zeigen, wie lange Sie für das jeweilige Kapitel brauchen sollten.
Diese Zeitangabe dient aber nur als Orientierung. Am Ende müssen Sie nur die Planung der Lehrkraft und Ihre eigene Zeitplanung beachten.
Bild: clock by Mr. Minuvi from the Noun Project
Bewertung
Die Bewertung im Semester erfolgt anhand von:
- Tests
- Protokollen
- Mitarbeit im Unterricht bei der Sicherung und Diskussion von Inhalten
- digitalem Portfolio
- ggf. Klausur
Auf Grund unvorhergesehener Umstände (z.B. Pandemie) kann sich diese Liste auch ändern. Bitte halten Sie mit Ihrer Lehrkraft Rücksprache.
Das digitale Portfolio
Das Portfolio ist ein Teil der Arbeit und Bewertung. Zum einen dient es der Sicherung und Sammlung aller Arbeitsergebnisse. Sie können und sollten in diesem Portfolio alles sammeln, was Sie an Materialien und Produkten selbst erarbeitetet haben. Die zweite Funktion des Portfolios ist die Darstellung Ihrer eigenen Entwicklung. Mit Hilfe des Portfolios belegen Sie Ihren Lernfortschritt und reflektieren Ihre Arbeitsergebnisse und Arbeitsweisen. Diese Reflexion sollte sich auf alle Arbeitsprozesse, wie z.B. Recherchen oder Gruppenarbeiten, beziehen. Die Selbstreflexion sollte unabhängig von den Arbeitsaufträgen der Lehrkraft erfolgen.
Darüber hinaus können Sie dieses Portfolio auch als Teil Ihrer zukünftigen Bewerbungsmappen nutzen. Ihr zukünftiger Arbeitgeber erlangt dadurch ein umfassenderes Bild von Ihnen. Sehen Sie das Portfolio also nicht nur als weiteren Schulhefter sondern auch als Selbstdarstellungsmöglichkeit.
Die Bewertung des Portfolios erfolgt zum Ende des jeweiligen Semesters und erfolgt mit Hilfe des gegebenen Bewertungsrasters.
Hilfreiche Fragen für die Reflexion
Falls Sie anfangs bei der Reflexion Probleme haben, können Sie sich erst einmal an diesen Fragen orientieren. Die Reflexion sollten Sie regelmäßig durchführen und als Fließtext ausformulieren.
- Habe ich die Zeit effektiv genutzt?
- Habe ich alle Aufträge gelöst?
- Habe ich alles verstanden?
- Habe ich gut allein gearbeitet?
- Habe ich gut in der Gruppe gearbeitet?
- Was kann ich in der nächsten Stunde besser machen?
Netzdiagramm zur Schnellreflexion
In Ihrem digitalen Portfolio sollen Sie Ihren Arbeits- und Lernprozess sinnvoll reflektieren um Verbesserungsmöglichkeiten zu finden und dann umzusetzen. Dazu sollten Sie regelmäßig, also beispielsweise nach jedem Kapitel, eine Reflexion durchführen.
Dieses Netzdiagramm soll Ihnen dabei helfen. Sie können den Code für das Diagramm an die jeweilige Stelle in ihrem digitalen Portfolio kopieren und dort anpassen. Dadurch visualisieren Sie für sich ihren Fortschritt. Am Ende sollte das Netzdiagramm komplett gefüllt sein.
Zusätzlich sollten Sie die Reflexion in einem Fließtext ausformulieren. Das könnten Seite auch unterhalb des Diagramms in Ihrem Portfolio machen.
Bewertung des digitalen Portfolios
| Umsetzung digitales Portfolio (Gewicht: 1) | |
|---|---|
| 1BE | 2BE |
| HTML | schönes HTML |
| 3BE | 4BE |
| HTML,CSS | schönes HTML, schönes CSS (JavaScript) |
| Dokumentation (Gewicht: 2) | |
|---|---|
| 1BE | 2BE |
| Weniger als zur Hälfte erfüllt | Mehr als zur Hälfte erfüllt |
| 3BE | 4BE |
| Weitgehend erfüllt | Vollständig erfüllt |
| Reflexion (Gewicht: 3) | |
|---|---|
| 1BE | 2BE |
| Kaum Reflexionsfähigkeit erkennbar. Die Kurzreflexionen wurden selten genutzt oder das Semester wurde abschließend reflektiert oder die Reflexion wurde während des Semsters manchmal vorgenommen. | Reflexionsfähigkeit zum Teil erkennbar. Die Kurzreflexionen wurden selten genutzt. Das Semester wurde abschließend reflektiert oder die Reflexion wurde während des Semsters manchmal vorgenommen. |
| 3BE | 4BE |
| Gute Reflexionsfähigkeit erkennbar. Die Reflexion wurde mehrfach während des Semsters vorgenommen. Die Kurzreflexionen wurden genutzt. Das Semester wurde abschließend ergänzend reflektiert. | Sehr gute Reflexionsfähigkeit erkennbar. Die Reflexion wurde mehrfach während des Semsters vorgenommen. Die Kurzreflexionen wurden sinnvoll genutzt. Das Semester wurde abschließend ausführlich ergänzend und glaubhaft reflektiert. |
Die Dokumentation der Arbeit enthält z.B. die Lösungen zu den Arbeitsaufträgen, weitere (digitalisierte) Mitschriften, Quellen, Recherchen, gezeichnete oder ausgedruckte Bilder, Mind-Maps sowie verlinkte Videos und Webseiten. Dabei ist darauf zu achten, dass eine Sammlung von abfotografierten Heftseiten keine digitale Dokumentation im Sinne des digitalen Portfolios darstellt. Die durchgängige Reflexion beinhaltet die Arbeit in der Klasse, in der Gruppe, Einzelarbeit, die Reflexion des Erkenntnisstands etc. Die Lehrkraft kann in den Kategorien Dokumentation und Reflexion jeweils 1 bzw. 2BE von der Bewertung individuell abziehen.
Grundlagen
Um den Zusammenhang von chemischen Reaktionen und Energieumwandlungen zu verstehen, braucht man einige Grundbegriffe.
Die wichtigsten Grundbegriffe
Auftrag: Erarbeiten Sie sich die grundlegenden Begriffe und Konzepte, die für dieses Thema nötig sind.
- Erläutern Sie an selbstgewählten Beispielen den Unterschied zwischen offenen, geschlossenen und isolierten/abgeschlossenen Systemen.
- Definieren Sie die Begriffe Energie, Wärme und Enthalpie.
- Definieren Sie den Begriff innere Energie.
- Erklären Sie den Unterschied zwischen Stromfluss in Metallen, in wässrigen Salzlösungen und Salzschmelzen.
- Erläutern Sie den ersten Hauptsatz der Thermodynamik.
Reaktionswärme
Bei verschiedenen chemischen Reaktionen kommt es zur Absorption oder Emission von Energie. In diesem Kapitel sollen Sie sich mit zwei Beispielen genauer beschäftigen.
Verbrennungsenthalpie - Vorüberlegungen
Auftrag: Erarbeiten Sie sich die grundlegenden Kenntnisse, bevor Sie das Experiment durchführen.
- Erläutern Sie den Aufbau eines Kalorimeters und beschreiben Sie ein Kalorimeter-Experiment.
- Ein Beispiel wie solch ein Kalorimeter-Experiment funktioniert finden sie hier.
- Definieren Sie den Begriff Wärmekapazität und erklären Sie wie man die entsprechende Formel anwendet.
- Erklären Sie die Begriffe Brennwert, Heizwert und Verbrennungsenthalpie sowie endo- und exotherme Reaktion.
Verbrennungsenthalpie - Experiment
Auftrag: Bestimmen Sie experimentell die Menge an Energie, die in einem Mol Ethanol enthalten ist.
- Schreiben Sie ein ausführliches Protokoll im Unterricht!
- Für die Auswertung: Recherchieren Sie den tabellarischen Wert. Vergleichen Sie den experimentellen Wert dann in Ihrer Auswertung und erklären Sie, wie es gegebenenfalls zu Abweichungen kommen kann.
Verbrennungsenthalpie - Übungsaufgabe
Auftrag: Berechnen Sie die Masse an Erdgas (zur Vereinfachung Methangas), die man spart, wenn man ein Schwimmbad nicht auf 25°C sondern 22°C heizt.
- Gehen Sie von einem Schwimmbad mit den Maßen 25mx12mx2,5m aus.
- Gehen Sie davon aus, dass das Wasser mit 20°C aus der Leitung kommt.
- Zur Vereinfachung gehen wir davon aus, dass die komplette Verbrennungsenthalpie zur Heizung des Wassers genutzt wird.
Lösungsenthalpie - Vorüberlegungen
Auftrag: Erarbeiten Sie sich die grundlegenden Kenntnisse, bevor Sie das Experiment durchführen.
- Erläutern Sie den Aufbau von Salzen an einem selbstgewählten Beispiel. Nennen Sie einige Ihnen bekannte Salze!
- Beschreiben Sie detailliert die Vorgänge beim Lösen von Salzen auf der Teilchenebene!
Lösungsenthalpie - Experiment
Auftrag: Bestimmen Sie experimentell die Lösungsenthalpie verschiedener Salze!
- Schreiben Sie ein ausführliches Protokoll im Unterricht!
- Für die Auswertung:
- Stellen Sie die Reaktionsgleichung für den Lösungsvorgang auf.
- Berechnen Sie die Stoffmengenkonzentration der entstandenen Lösungen.
- Erläutern Sie die chemischen Hintergründe ihre Beobachtungen mit Hilfe von chemischen Gleichungen und Berechnungen. Denken Sie dabei an formale Rechenwege!
- Erklären Sie die Begriffe Lösungsenthalpie, Gitterernergie, Hydratisierung und Hydratisierungsenthalpie.
- Erläutern Sie warum bei der Lösung von einigen Salzen Energie frei wird (exotherm) und bei anderen Energie benötigt wird (endotherm).
- Vergleichen Sie Ihre Werte mit den Standardwerten in der Literatur. Diskutieren Sie ggf. Abweichungen auch in Ihrer Fehleranalyse.

Achten Sie darauf, dass alle Chemikalien Raumtemperatur haben. Füllen Sie eine Spatelspitzen
(vorher wiegen) der gegebenen Salze in ein (großes) Reagenzglas. Messen Sie die Temperatur des
Feststoffs, das Thermometer bleibt im RG. Geben Sie 5ml destilliertes Wasser dazu. Messen Sie die
Temperatur im 30sek Takt.
HINWEIS: Sollten die Meßwerte nicht eindeutig genug sein, überlegen Sie sich selbstständig Ver-
besserungsmöglichkeiten für das Experiment und führen Sie es erneut – nach Rücksprache mit der
Lehrkraft – durch.
Satz von Hess
Man kann Stoffe manchmal auf verschiedenen Wegen herstellen. Quasi, mehrere Wege führen zum chemischen Rom. Dieser Zusammenhang hat auch Auswirkungen auf die energetische Betrachtung von Reaktionswegen. Dazu dient der Satz von Hess.
Satz von Hess - Experiment
Auftrag: Führen Sie die gegebenen Experimente durch! Schreiben Sie ein einfaches Protokoll. Sei benötigen keine Hypothese! Beantworten Sie die folgenden Fragen als Teil der Auswertung.
- Bestimmen Sie die Stoffmengenkonzentration der entstandenen Lösungen.
- Erläutern Sie die chemischen Hintergründe ihrer Beobachtungen mit Hilfe von chemischen Gleichungen.
- Erläutern Sie die chemischen Hintergründe auch in Bezug auf das hier dargestellt Diagramm und des Satz von Hess!

Experiment 1a: 1g festes NaOH(s) wird im trockenen Kalorimetergefäß abgewogen. 50 ml Wasser, dessen Temperatur vorher bestimmt wurde, werden hinzugefügt. Bis alle NaOH - Plätzchen restlos gelöst sind, wird mit dem Thermometer vorsichtig gerührt. Die Endtemperatur (T2) wird bestimmt.
Experiment 1b: Es werden nach vorangehender Temperaturmessung (T1) 50 ml 0.5 M NaOH(aq) mit 50 ml 0.5 M HCl(aq) versetzt und mit einem sauberen Thermometer gut durchmischt. Die Endtemperatur (T2) wird bestimmt.
Experiment 2: Im trockenen Kalorimetergefäß wird 1 g NaOH(s) eingewogen. 100 ml 0.25 M HCl(aq), deren Temperatur vorher bestimmt wurde (T1), werden hinzu gegeben. Mit dem Glasstab wird vorsichtig gerührt, bis die NaOH - Plätzchen restlos gelöst sind. Die Endtemperatur (T2) wird bestimmt.
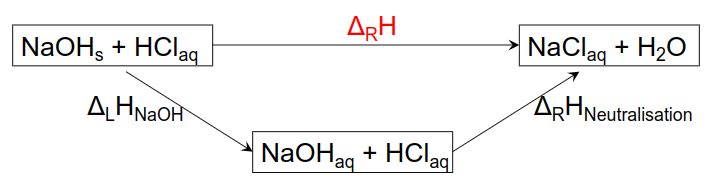
Standardreaktionsenthalpie
Ausgehend vom Satz von Hess kann man für alle Reaktionen die Reaktionsenthalpie berechnen, die frei wird oder gebraucht wird. Dazu benötigt man die Standardbildungsenthalpie.
Standardbildungsenthalpie
Auftrag: Erläutern Sie am Beispiel des Kalkbrennens den Zusammenhang von Standardbildungsenthalpie und Standardreaktionsenthalpie!
- Stellen Sie die Reaktionsgleichung für das Kalkbrennen auf!
- Erläutern Sie, wie man die molaren Standardbildungsenthalpien bestimmt. Nutzen Sie dafür die Produkte des Kalkbrennens als Beispiel!
- ErläuternSie anschliessend, wie man die Standardreaktionsenthalpie für das Kalkbrennen bestimmen kann!
- Erklären Sie, in welchen Bereichen die Standardreaktionsenthalpie liegen muss, wenn es sich um eine exotherme oder endotherme Reaktion handelt.
- Berechnen Sie die Energiemenge, die gebraucht wird um eine Tonne gebrannten Kalk herzustellen!
- Bewerten Sie die Eignung des Kalkbrennens als Energiespeicher! Berechnen Sie dafür auch, wie viel Energie kurzfristig beim Kalklöschen wieder ”erzeugt” wird!