Skript - Gleichgewichte
Einführung
Mit Hilfe dieses Skriptes sollen Sie sich das Thema Gleichgewichte in der Chemie selbstständig erarbeiten. Selbstständig bedeutet wirklich SELBST und STÄNDIG.
Der Unterricht im klassischen Sinne hat aufgehört. Sie können Ihr eigenes Tempo bestimmen und sich Ihre eigenen Partner suchen. Sollte die Lehrkraft nicht da sein, haben Sie nun immer das Material um selbstständig zu arbeiten.
Die Lehrkraft soll Ihnen dabei als Berater zur Seite stehen. Wenn Sie Fragen haben oder auf Probleme stoßen, die Sie weder allein noch im Team lösen konnten, dann fragen Sie nach!
Für jedes Kapitel dieser Reihe ist angegeben, wie Sie vorgehen sollten. Die Vorüberlegungen sollen Ihnen helfen Wissen zu reaktivieren oder Wissenslücken zu schließen. Wenn Sie sich an die vorgegebenen Vorgehensweisen hallten, sollte es keine Probleme geben.
Vielleicht fragen Sie sich jetzt, warum die Lehrer so faul sein dürfen und Sie jetzt alles allein machen müssen. Der Grund ist recht einfach: die Lehrer haben alles bereits so vorbereitet, dass Sie sich intensiv mit einem Thema beschäftigen können. Dadurch bleibt es besser in Ihrem Gedächtnis. Sie lernen effektiver die Inhalte, verbessern Ihr eigenes Zeitmanagement und analysieren Ihre eigenen Fähig- und Fertigkeiten.
Symbole im Skript

In diesen Texten finden Sie Erklärungen und Hintergründe!
Die Quellen finden Sie in den Fußnoten. Diese Quellen können Ihnen auch als Quizvorbereitung helfen.
Übrigens, nicht alle Quellen sind Wikipedia. Aber es ist eine nützliche und in Chemie akzeptierte Quelle.
Bild: Information by dDara from the Noun Project

An diesen Stellen sollen Sie Ihr Wissen auffrischen!
Sie sollten die entsprechenden Themen schon vorher im (Chemie-)Unterricht behandelt
haben.
Falls nicht, arbeiten Sie Ihre Wissenslücken bitte selbstständig auf.
Bild: Arrow by Aleksandr Vector from the Noun Project

Es soll keine Langeweile aufkommen.
Wenn Sie mit den Aufträgen bereits fertig sind, während Ihre Gruppe noch arbeitet,
können Sie sich hier noch weiter in das Thema vertiefen.
Bild: thunder by Pascal Heß from the Noun Project

Dieses Symbol weißt immer auf eine Durchführung für ein Experiment hin.
Bild: Chemistry by Eucalyp from the Noun Project

Das Zeitsymbol soll Ihnen zeigen, wie lange Sie für das jeweilige Kapitel brauchen sollten.
Diese Zeitangabe dient aber nur als Orientierung. Am Ende müssen Sie nur die Planung der Lehrkraft und Ihre eigene Zeitplanung beachten.
Bild: clock by Mr. Minuvi from the Noun Project
Bewertung
Die Bewertung im Semester erfolgt anhand von:
- Tests
- Protokollen
- Mitarbeit im Unterricht bei der Sicherung und Diskussion von Inhalten
- digitalem Portfolio
- ggf. Klausur
Auf Grund unvorhergesehener Umstände (z.B. Pandemie) kann sich diese Liste auch ändern. Bitte halten Sie mit Ihrer Lehrkraft Rücksprache.
Das digitale Portfolio
Das Portfolio ist ein Teil der Arbeit und Bewertung. Zum einen dient es der Sicherung und Sammlung aller Arbeitsergebnisse. Sie können und sollten in diesem Portfolio alles sammeln, was Sie an Materialien und Produkten selbst erarbeitetet haben. Die zweite Funktion des Portfolios ist die Darstellung Ihrer eigenen Entwicklung. Mit Hilfe des Portfolios belegen Sie Ihren Lernfortschritt und reflektieren Ihre Arbeitsergebnisse und Arbeitsweisen. Diese Reflexion sollte sich auf alle Arbeitsprozesse, wie z.B. Recherchen oder Gruppenarbeiten, beziehen. Die Selbstreflexion sollte unabhängig von den Arbeitsaufträgen der Lehrkraft erfolgen.
Darüber hinaus können Sie dieses Portfolio auch als Teil Ihrer zukünftigen Bewerbungsmappen nutzen. Ihr zukünftiger Arbeitgeber erlangt dadurch ein umfassenderes Bild von Ihnen. Sehen Sie das Portfolio also nicht nur als weiteren Schulhefter sondern auch als Selbstdarstellungsmöglichkeit.
Die Bewertung des Portfolios erfolgt zum Ende des jeweiligen Semesters und erfolgt mit Hilfe des gegebenen Bewertungsrasters.
Hilfreiche Fragen für die Reflexion
Falls Sie anfangs bei der Reflexion Probleme haben, können Sie sich erst einmal an diesen Fragen orientieren. Die Reflexion sollten Sie regelmäßig durchführen und als Fließtext ausformulieren.
- Habe ich die Zeit effektiv genutzt?
- Habe ich alle Aufträge gelöst?
- Habe ich alles verstanden?
- Habe ich gut allein gearbeitet?
- Habe ich gut in der Gruppe gearbeitet?
- Was kann ich in der nächsten Stunde besser machen?
Netzdiagramm zur Schnellreflexion
In Ihrem digitalen Portfolio sollen Sie Ihren Arbeits- und Lernprozess sinnvoll reflektieren um Verbesserungsmöglichkeiten zu finden und dann umzusetzen. Dazu sollten Sie regelmäßig, also beispielsweise nach jedem Kapitel, eine Reflexion durchführen.
Dieses Netzdiagramm soll Ihnen dabei helfen. Sie können den Code für das Diagramm an die jeweilige Stelle in ihrem digitalen Portfolio kopieren und dort anpassen. Dadurch visualisieren Sie für sich ihren Fortschritt. Am Ende sollte das Netzdiagramm komplett gefüllt sein.
Zusätzlich sollten Sie die Reflexion in einem Fließtext ausformulieren. Das könnten Seite auch unterhalb des Diagramms in Ihrem Portfolio machen.
Bewertung des digitalen Portfolios
| Umsetzung digitales Portfolio (Gewicht: 1) | |
|---|---|
| 1BE | 2BE |
| HTML | schönes HTML |
| 3BE | 4BE |
| HTML,CSS | schönes HTML, schönes CSS (JavaScript) |
| Dokumentation (Gewicht: 2) | |
|---|---|
| 1BE | 2BE |
| Weniger als zur Hälfte erfüllt | Mehr als zur Hälfte erfüllt |
| 3BE | 4BE |
| Weitgehend erfüllt | Vollständig erfüllt |
| Reflexion (Gewicht: 3) | |
|---|---|
| 1BE | 2BE |
| Kaum Reflexionsfähigkeit erkennbar. Die Kurzreflexionen wurden selten genutzt oder das Semester wurde abschließend reflektiert oder die Reflexion wurde während des Semsters manchmal vorgenommen. | Reflexionsfähigkeit zum Teil erkennbar. Die Kurzreflexionen wurden selten genutzt. Das Semester wurde abschließend reflektiert oder die Reflexion wurde während des Semsters manchmal vorgenommen. |
| 3BE | 4BE |
| Gute Reflexionsfähigkeit erkennbar. Die Reflexion wurde mehrfach während des Semsters vorgenommen. Die Kurzreflexionen wurden genutzt. Das Semester wurde abschließend ergänzend reflektiert. | Sehr gute Reflexionsfähigkeit erkennbar. Die Reflexion wurde mehrfach während des Semsters vorgenommen. Die Kurzreflexionen wurden sinnvoll genutzt. Das Semester wurde abschließend ausführlich ergänzend und glaubhaft reflektiert. |
Die Dokumentation der Arbeit enthält z.B. die Lösungen zu den Arbeitsaufträgen, weitere (digitalisierte) Mitschriften, Quellen, Recherchen, gezeichnete oder ausgedruckte Bilder, Mind-Maps sowie verlinkte Videos und Webseiten. Dabei ist darauf zu achten, dass eine Sammlung von abfotografierten Heftseiten keine digitale Dokumentation im Sinne des digitalen Portfolios darstellt. Die durchgängige Reflexion beinhaltet die Arbeit in der Klasse, in der Gruppe, Einzelarbeit, die Reflexion des Erkenntnisstands etc. Die Lehrkraft kann in den Kategorien Dokumentation und Reflexion jeweils 1 bzw. 2BE von der Bewertung individuell abziehen.
Die Gleichgewichtsreaktion
Viele Reaktionen in der Chemie erreichen einen Punkt, ab dem sie sich im Gleichgewicht befinden. Hier sollen Sie sich die wesentlichen Aspekte einer allgemeinen Gleichgewichtsreaktion erarbeiten.
Reaktionsgeschwindigkeit
Auftrag: Erarbeiten Sie sich mit Hilfe der Quelle das Konzept der Reaktionsgeschwindigkeit.
- Nutzen Sie die Quelle um die folgenden Fragen zu beantworten.
- Formulieren Sie für die Reaktionen von HCl und Zink die Reaktionsgleichung auf.
- Erläutern Sie an einem selbstgewählten Beispiel den Begriff (Säure-)Konzentration!
- Erläutern Sie das Konzept der Stoßtheorie!
- Erläutern Sie den Begriff Reaktionsgeschwindigkeit!
- Erklären Sie wie man die Reaktionsgeschwindigkeit erhöhen kann!
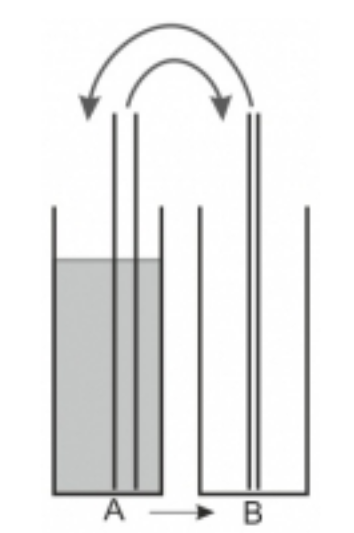
Der Stechheberversuch
Auftrag: Untersuchen Sie das Konzept der Gleichgewichtsreaktion mit Hilfe des Stechheberversuchs.
- Informieren Sie sich kurz über das Konzept der Gleichgewichtsreaktion.
- Führen Sie das Modellexperiment durch.
- Schreiben Sie ein einfaches Protokoll. Tabellarisieren Sie dabei ihre Meßergebnisse und stellen Sie sie in der Auswertung grafisch (Übung zu Spreadsheet!!) dar.
- Vergleichen Sie die Meßergebnisse der drei Versuche.
- Erläutern Sie das Prinzip des chemischen Gleichgewichts mit Hilfe des Versuchs.

Füllen Sie einen Meßzylinder (A) mit Wasser. Nehmen Sie einen zweiten, gleichgroßen Meßzylinder (B) und lassen Sie ihn leer. Notieren Sie den Volumenstand von A und B.
- Nehmen Sie zwei Glasrohre mit gleichem Durchmesser. Stellen Sie in jeweils einen Zylinder ein Glasrohr. Verschließen Sie das obere Ende mit Ihrem Daumen und geben Sie die Flüssigkeit, die in dem Glasrohr ist, in den jeweils anderen Meßzylinder. Notieren Sie den Volumenstand in A und B. Wiederholen Sie diesen Vorgang 30mal.
- Nehmen Sie zwei Glasrohre, die einen größeren oder kleineren Durchmesser als in Versuch 1 haben. Wiederholen Sie das Experiment.
- Nehmen Sie zwei Glasrohre mit unterschiedlichem Durchmesser. Wiederholen Sie das Experiment.
Das Massenwirkungsgesetz
Auftrag: Erläutern Sie den Begriff Massenwirkungsgesetz am Beispiel der Iodwasserstoff-Synthese!
- Recherchieren Sie den Begriff Massenwirkungsgesetz!
- Lesen Sie den Text und stellen Sie die Reaktionsgleichung für die Produktion von Iodwasserstoff.
- Formulieren Sie das MWG für die Reaktion. Nennen Sie die Einheit der Gleichgewichtskonstante.
- Erläutern Sie, wie sich die Konzentration von Edukten und Produkten im Verlauf der Reaktion ändern. Nehmen Sie einen allgemeinen Verlauf der Reaktion an.
- Erläutern Sie wie sich die Reaktion ändern würde, wenn der Katalysator (hypothetisch) weggelassen wird. Nennen Sie die drei definierenden Eigenschaften eines Katalysators.
- Vermuten Sie, welche Bedeutung das MWG für die chemische Industrie haben kann. Überlegen Sie dabei, welche Wertebereiche K annehmen kann und was sie bedeuten.
- Formulieren Sie das Massenwirkungsgesetz für die allgemeine Reaktionsgleichung aA + bB ⇄ cC + dD auf!

Iodwasserstoff (Summenformel HI)ist ein farbloses, stechend riechendes, giftiges Gas, das sich sehr gut in Wasser unter Bildung der sehr starken Iodwasserstoffsäure löst. Industriell erfolgt die Herstellung durch katalytische Reaktion der gasförmigen Elemente über einen auf 500°C erwärmten Platin-Schwamm als Katalysator. (Quelle (zusammengefasst): Wikipedia)
LeChatelier
Bisher haben Sie sich nur mit dem Gleichgewichtszustand beschäftigt. Für viele Prozesse in Natur und Technik ist es wichtiger, dass sich das Gleichgewicht verschiebt. Der Chemiker Henri LeChatelier hat sich ausführlich mit dem chemischen Gleichgewicht beschäftigt und das Prinzip des kleinsten Zwangs aufgestellt.
Die Verschiebung des chemischen Gleichgewichts
Auftrag: Erarbeiten Sie sich mit Hilfe der Experimente die wesentlichen Aussagen zu den Prinzipien von Le Chatelier
- Lesen Sie die Durchführungen, führen Sie die Experimente durch und schreiben Sie ein ausführliches Protokoll!
- Für die Hypothese: Stellen Sie Vermutungen für die folgenden allgemeinen Reaktionen auf. Dabei sollen Sie noch keine Recherchen betreiben.
- Die Reaktion 2A(g) + B(g) ⇄ C(g) soll durch Druck beeinflusst werden. Erklären Sie, welches Volumen alle gasförmigen Stoffe (bezogen auf ein Mol) haben? Vermuten Sie, wie sich ein hoher Druck bzw. ein niedriger Druck auswirken könnten?
- Die Hinreaktion der Gleichgewichtsreaktion A + B ⇄ C + D verläuft exotherm. Vermuten Sie, wie man das Gleichgewicht mit Hilfe der Temperatur verschieben könnte?

Verschiebung mit Hilfe der Temperatur:
Stelle eine Stärkelösung her, indem du lösliche Stärke in Wasser aufkochst (w = 1\%). Lasse abkühlen. Statt dieser Lösung kannst du auch Kartoffelkochwasser nehmen, das du allerdings 1:10 verdünnen musst. Fülle ein Reagenzglas halbvoll mit Stärkelösung. Gib dann Iodtinktur hinzu und vermische jedes Mal gut. Du wirst feststellen, dass die Farbe anfänglich wieder verschwindet. Das liegt daran, dass sich die Iodmoleküle auf alle Stärkemoleküle gleichmäßig verteilen, ohne die farbgebenden Ketten aufzubauen. Gib deshalb langsam soviel Lugol-Lösung zu, bis die blaue Farbe auch nach 1-2 min noch stabil bleibt.
Parallel dazu bereitest du ein Glas mit heißem Wasser vor. In dieses stellst du dann das Gläschen mit der blauen Mischung. Beobachte. Lasse nun das Reagenzglas abkühlen, indem du es in kaltes Wasser stellst.

Verschiebung mit Hilfe des Drucks:
Zunächst präpariert man eine Spritze mit einem Loch im Stempel. Dazu zieht man den Stempel maximal heraus und durchbohrt ihn mit einem erhitzten Nagel. Mit dem Nagel kann man den Stempel später bei Unterdruck fixieren.
Dann zieht man in diese Spritze 10mL Wasser mit wenig Indikator und sprudelt Kohlenstoffdioxid durch das Wasser, bis die Farbe eben nach gelb umschlägt (ca. 5mL). Überschüssiges Kohlenstoffdioxid wird verworfen (vorsichtig aus Spritze drücken) und die Flüssigkeit auf zwei Spritzen verteilt und diese verschlossen. Die zweite Spritze dient später dem Farbvergleich. Der Stempel der präparierten Spritze wird maximal herausgezogen und fixiert. Die Lösung wird geschüttelt. Beobachten.

Verschiebung durch Konzentrationsänderung: 0,27 g Eisen(III)chlorid und 0,29 g Kaliumthiocyanat werden abgewogen und in je 300 mL Wasser gelöst. In die drei Bechergläser werden jeweils gleiche Mengen der beiden Lösungen gegeben. In das eine Becherglas wird anschließend festes Eisen(III)chlorid, in ein anderes festes Kaliumthiocyanat gegeben. Das dritte Becherglas dient als Vergleichslösung.
Säure-Base-Gleichgewichte
Bisher haben wir Säuren und Basen immer getrennt bearbeitet. Aber auch hier hat sich die Wissenschaft weiterentwickelt und man hat festgestellt, dass auch Säuren und Basen mit chemischen Gleichgewichten zu tun haben. Wie das funktioniert, sollen Sie in diesem Abschnitt erarbeiten.
Brönstedt-Definition
Sie haben sich in den vorherigen Klassenstufen größtenteile mit Säuren und Basen nach der Definition von Arrhenius beschäftigt. Nun ist es Zeit diese wichtigen chemischen Begriffe zu erweitern.
Auftrag: Erarbeiten Sie sich experimentell die Definition der Säuren und Basen nach Brönstedt.
- Wiederholen Sie die Definition von Säuren und Basen nach Arrhenius.
- Lesen Sie die Durchführung und führen Sie das Experiment durch. Protokollieren Sie das Experiment.
- Erklären Sie in Ihrer Hypothese, warum Ammoniak keine Arrhenius-Base sein kann.
- Beantworten Sie die gegebenen Fragen als Teil der Auswertung.
- Recherchieren Sie die Begriffe Brönstedt-Säure und -Base.
- Erläutern Sie mit Hilfe einer Reaktionsgleichung ihre Beobachtungen.
- Erläutern Sie mit obiger Gleichung das den Begriff korrespondierende Säure-Base Paare.
- Erklären Sie, warum Natriumhydroxid zwar eine Arrhenius-Base, aber keine Brönstedt-Base ist.

Prüfen Sie den pH-Wert von konzentriertem Ammoniak! Füllen Sie einige Tropfen auf ein Uhrglass. Halten Sie einen trockenen Indikatorstreifen über die Flüssigkeit. Feuchten Sie das Indikatorpapier dann an und halten Sie es erneut über den Ammoniak.
Autoprotolyse des Wassers
Destilliertes Wasser sollte eigentlich keinen Strom leiten. Wer es aber misst, stellt fest, dass es doch Strom leitet. Woher kommen aber die freien Ladungsträger, die wir als Strom messen?
Auftrag: Erklären Sie mit Hilfe der Fragen, warum Wasser Strom leiten kann.
- Erläutern Sie den Begriff Protolyse.
- Erläutern Sie den Begriff Autoprotolyse des Wassers.
- Erläutern Sie den Begriff Oxonium-Ion.
- Erklären Sie, warum Wasser auch als Ampholyt bezeichnet wird.
- Erläutern Sie den Begriff Ionenprodukt des Wassers.
Der pH-Wert
Der pH-Wert sollte Ihnen schon seit der 9.Klasse immer wieder über den Weg gelaufen sein. Allerdings wurden bis jetzt nie die eigentlichen Hintergründe erklärt. Dafür haben Sie nun das chemische und mathematische Rüstzeug.
Auftrag: Erläutern Sie das Konzept des pH-Werts.
- Erläutern Sie den Begriff pH-Wert.
- Erläutern Sie, warum der pH-Wert von Wasser 7 beträgt.
- Erläutern Sie den Begriff pOH-Wert.
Starke und schwache Säuren und Basen
Auftrag: Erläutern Sie das Konzept starker und schwacher Säuren und Basen.
- Leiten Sie an einem selbstgewählten Beispiel die Gleichgewichtskonstante KS für das Protolysegleichgewicht einer Brönstedt-Säure her. Leiten Sie außerdem die Gleichgewichtskonstante KB für das Protolysegleichgewicht einer Brönstedt-Base her.
- Erklären Sie die Bedeutung der Gleichgewichtskonstanten.
- Erläutern Sie den pKS- und pKB-Wert.
- Erklären Sie die Begriffe starke und schwache Säuren bzw. Basen.
- Erläutern Sie den Zusammenhang von pKS und pH-Wert bei starken Säuren. Erläutern Sie auch das Äquivalent für Basen.
- Berechnen Sie den pH-Wert einer Salzsäure mit c(HCl) = 0,01mol/l.